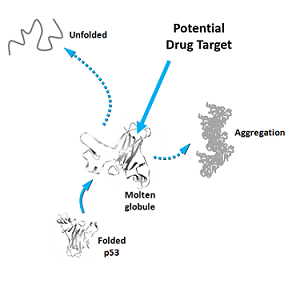
Uma descoberta de pesquisadores brasileiros pode trazer luz ao desenvolvimento de novos tratamentos contra o câncer. Eles conseguiram estimular e observar em laboratório o estágio pré-inicial da doença, capturando o exato momento em que a proteína p53 (conhecida como guardiã do genoma) encontra-se no chamado estado de glóbulo fundido (molten globule) – curto período em que a molécula apresenta potencial para sofrer alterações que levam ao surgimento de tumores. Devido à pouca estabilidade da p53 mutada, as chances de ocorrência de estruturas do tipo glóbulo fundido na proteína e, portanto, de células cancerígenas são altas. A mutação da p53 está presente em mais da metade dos casos de câncer e compreender o que leva à sua alteração oncogênica pode permitir o surgimento de novas estratégias de combate à doença. O estudo foi liderado pelo Acadêmico Jerson Lima da Silva, professor do Instituto de Bioquímica Médica Leopoldo de Meis (IBqM) e do Centro Nacional de Biologia Estrutural e Bioimagem (CENABIO) da UFRJ e coordenador do Instituto Nacional de Ciência e Tecnologia de Biologia Estrutural e Bioimagem (INBEB), com co-autoria de Murilo M. Pedrote, Guilherme A. P. de Oliveira e outros.
A proteína p53 é peça fundamental na inibição da formação de câncer no organismo. É importante que ela esteja com o enovelamento (ou dobramento) correto para impedir o surgimento de moléculas alteradas que se multipliquem desordenadamente e deem origem a tumores. Sua versão mutada, no entanto, perde essa função e assume novos comportamentos. Um deles é agir justamente no sentido contrário, contribuindo para a formação de agregados amiloides, um conjunto de p53 mutantes que “contaminam” as p53 originais, no chamado efeito priônico, aumentando ainda mais tais agregados. Seu crescimento é rápido e sua degradação, difícil.
Entre sua forma nativa e o estado alterado que estimula o surgimento de agregados, a p53 assume um estágio transiente de glóbulo fundido. Trata-se de um breve momento em que a proteína ainda não forma estruturas amiloides, mas apresenta um grande potencial para tanto. Por ser pouco estável, a p53 mutada apresenta alta probabilidade de formar estruturas do tipo glóbulo fundido e, portanto, agregados amiloides. Compreender os gatilhos que levam à transformação da p53 nativa à sua versão mutada abre portas para que se desenvolvam novos tratamentos no combate ao câncer.
Estudar a transição entre as duas versões da proteína tem sido um desafio para os pesquisadores, devido ao curto período durante o qual o processo ocorre. O grupo liderado por Silva, no entanto, conseguiu desenvolver uma abordagem que permitiu capturar, em solução, a p53 nesse estágio logo antes de sofrer a mutação. Para tanto, foram adotadas técnicas de bioquímica e biofísica, como a espectroscopia de fluorescência e ressonância magnética nuclear (RMN), utilizando o equipamento de 900 MHz recém instalado no CENABIO. Tais técnicas também foram aplicadas a outras duas proteínas relacionadas à p53: p63 e p73. Entre as três, a p53 foi a que se mostrou mais instável e propensa à agregação.
Em ambiente natural, a mutação da p53 pode ser desencadeada por diversas circunstâncias, como ação de vírus ou exposição a raios ultravioletas ou substâncias cancerígenas. Para simular as perturbações da vida real e provocar o desequilíbrio da proteína em laboratório, os pesquisadores recorreram a diferentes concentrações químicas e/ou alta pressão hidrostática. As alterações decorrentes foram observadas através de fluorescência e ressonância magnética nuclear (RMN). A estratégia adotada simula os mesmos processos de enovelamento incorreto e formação de agregados que ocorrem no corpo de um paciente com câncer, permitindo aos cientistas observarem mais de perto as mudanças conformacionais na estrutura antes que a proteína sofra alterações e alcance o estágio amiloide.
“Ter uma compreensão clara de todas as mudanças que ocorrem na molécula antes que ela assuma o estado amiloide talvez nos permita manipular este processo e ter a possibilidade de resgatar o estado nativo da proteína p53 ou bloquear sua transformação em oligômeros e fibrilas amiloides”, afirma Guilherme A. de Oliveira, um dos co-autores do estudo.
Ambas estratégias já chegaram a ser adotadas contra a p53 mutada por diferentes grupos de pesquisa, mas até agora os resultados não foram satisfatórios. O estudo brasileiro apresenta uma nova técnica para capturar, em solução, as diferentes conformações da p53 e aponta o estágio pré-amiloide da proteína como um alvo promissor para o desenvolvimento de novas drogas para o tratamento de tumores.
O artigo “Aggregation-primed molten globule conformers of the p53 core domain provide potential tools for studying p53C aggregation in cancer” foi publicado online no The Journal of Biological Chemistry (http://www.jbc.org/) no último dia 31 de maio de 2018.
